Beitrag unseres Partners: Bayer Vital GmbH
Kürzlich präsentierten namhafte Experten aktuelle Daten zu Nubeqa® (Darolutamid) und der Therapie des Hochrisiko-nmCRPC.
Der selektive, nicht-steroidale, orale Androgenrezeptor-Inhibitor (ARI) Nubeqa® (Darolutamid) in Kombination mit ADT stellt eine stark wirksame First-Line-Therapie mit besonders vorteilhaften Nebenwirkungsprofil für Männer mit nicht-metastasiertem kastrationsresistentem Prostatakarzinom dar, die ein hohes Risiko für die Entstehung von Metastasen aufweisen (Hochrisiko-nmCRPC).1,2 Die Therapie ermöglicht ein längeres Überleben bei gleichzeitigem Erhalt der Lebensqualität.
Dank der überzeugenden Evidenz wurden ARIs wie Nubeqa® sowohl in die neue S3-Leitlinie „Prostatakarzinom“ als auch in europäische Leitlinien aufgenommen. Diese befürworten bei Patienten mit Hochrisiko-nmCRPC die Therapie mit einem ARI plus Androgendeprivationstherapie (ADT) mit starkem Empfehlungsgrad.3,4
Die Phase-III-Studie ARAMIS
Prof. Dr. med. Ahmed Magheli, Bochum, präsentierte kürzlich prägnante Daten aus der Zulassungsstudie ARAMIS, die als multizentrische, randomisierte, placebokontrollierte Phase-III-Studie durchgeführt wurde. In ARAMIS wurden insgesamt 1.509 ARI-naive Patienten mit Hochrisiko-nmCRPC im Verhältnis 2:1 randomisiert und entweder einer Behandlung mit Nubeqa® oder Placebo zugeteilt und die Behandlung mit ADT fortgesetzt. In der Primäranalyse zeigte sich, dass Patienten unter Nubeqa® plus ADT ein medianes metastasenfreies Überleben (MFS) von 40,4 Monaten erreichten, während das MFS unter Placebo plus ADT nur 18,4 Monate betrug.1 Das Sterberisiko wurde durch die Behandlung mit Nubeqa® um 31% gesenkt.2
Mit einer Studienzusammenfassung in verständlicher Sprache können die inhaltlichen Aussagen der Studiendaten leichter erklärt werden. Dies beim Patientengespräch eine Unterstützung sein. Eine Zusammenfassung der ARAMIS-Studie in leicht verständlicher Sprache finden Sie hier.
Starke Wirksamkeit und vorteilhafte Verträglichkeit
Die europäischen Leitlinien betonen, dass mit Blick auf die Langzeitbehandlung asymptomatischer Patienten potenzielle Nebenwirkungen entsprechend berücksichtigt werden sollten. Bei Nubeqa® blieben die Inzidenzen der während der Behandlung auftretenden unerwünschten Ereignisse (UE) in ARAMIS niedrig und waren in den beiden Behandlungsarmen (Nubeqa® vs. Placebo) für potenziell alltagsbeeinträchtigende UE vergleichbar.1,2 Prof. Magheli hob hervor: „Darolutamid verdoppelte in ARAMIS das MFS und erwies sich als gut verträglich. Die Verträglichkeit spiegelte sich auch in der geringen Abbruchrate aufgrund von UE – 8,9 % unter Darolutamid vs. 8,7 % unter Placebo – wider. Diese kann als direktes Maß für die Verträglichkeit eines Wirkstoffs angesehen werden und lag in ARAMIS für Darolutamid auf Placebo-Niveau“. Darüber hinaus wies er darauf hin, dass die vorteilhaften Daten aus ARAMIS auch den G-BA dazu bewogen hätten, dem Wirkstoff insgesamt einen Hinweis auf einen beträchtlichen Zusatznutzen gegenüber dem abwartenden Vorgehen unter Beibehaltung der ADT zuzusprechen.6 Ein weiterer Pluspunkt von Darolutamid, so Magheli, sei das geringe Ausmaß erwartbarer klinisch bedeutsamer Arzneimittelwechselwirkungen.
Die Qual der Wahl beim Hochrisiko-nmCRPC: Hier gelangen Sie zu Prof. Dr. Axel Merseburgers Übersicht der Therapieoptionen in der European Urology Today.
DAROL: Erste Erfahrungen aus dem klinischen Alltag
Dr. Frank Becker, Neunkirchen, stellte erste Ergebnisse aus der nicht-interventionellen Studie DAROL vor. Die internationale, einarmige Beobachtungsstudie mit Nubeqa® bei Patienten mit Hochrisiko-nmCRPC untersucht, ob unter Alltagsbedingungen vergleichbar postive Ergebnisse wie in ARAMIS erreicht werden. Geeignete Teilnehmer sind Nubeqa®-naive Patienten mit bestätigtem Hochrisiko-nmCRPC, für die bereits vor Einschluss in die Studie die Therapieentscheidung für Darolutamid gefallen war. Die erste Interimsanalyse zeigte nun: Die Ergebnisse untermauern das vorteilhafte Sicherheits- und Wirksamkeitsprofil von Nubeqa® beim Hochrisiko-nmCRPC und bestätigen somit die Ergebnisse der ARAMIS Studie auch im klinischen Alltag.
Als Beispiel dafür stellte Dr. Becker den Fall eines 58-jährigen fitten Patienten vor, der bereits im Alter von 49 Jahren mit Hochrisiko-nmCRPC erstdiagnostiziert wurde. Trotz mehrfacher operativer Eingriffe habe dieser laut Becker einen persistierend hohen PSA-Wert aufgewiesen, der zu Beginn der Therapie mit einem GnRH-Blocker (ADT) bei 6,85 ng/mL lag. Der PSA-Wert nahm daraufhin zwar über 4 Monate ab, stieg dann jedoch wieder kontinuierlich an, so dass die PSA-Verdopplungszeit bei einem halben Jahr lag. Dennoch war das Testosteron unter alleiniger GnRH-Therapie stets im Kastrationsniveau. Aufgrund dieser Ergebnisse schlug Dr. Becker dem Patienten im Juni 2022 bei einem PSA-Wert von 4 ng/mL die Behandlung mit Nubeqa® bei Fortführung der ADT vor, woraufhin der PSA-Wert innerhalb nur eines Monats auf 0,28 ng/mL und seitdem weiterhin sank. Auch wurden bei dem Patienten bisher keine Nebenwirkungen beobachtet.
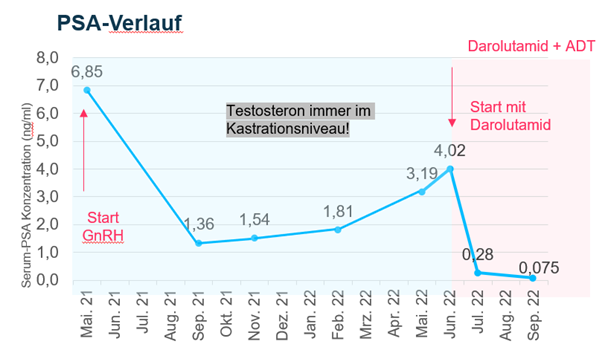
Becker spricht sich deshalb ausdrücklich für den frühen Einsatz von Nubeqa® bei jüngeren, asymptomatischen Patienten mit Hochrisiko-nmCRPC aus: „Aus meiner Erfahrung im klinischen Alltag profitieren gerade auch junge und fitte Patienten mit Hochrisiko-nmCRPC beträchtlich von Nubeqa® plus ADT in der First-Line-Therapie. Das zeigen auch die Daten der ersten Interimsanalyse von DAROL. Ich bin sehr froh, auch diesen Patienten eine so wirksame und gut verträgliche Therapie anbieten zu können.“
Quellen:
1 Fizazi K, et al. N Engl J Med 2019; 380(13): 1235–1246.
2 Fizazi K, et al. N Engl J Med 2020; 383(11): 1040–1049.
3 Leitlinienprogramm Onkologie, Version 6.2, Oktober 2021 S3-Leitlinie Prostatakarzinom. Online unter: https://www.leitlinienprogramm-onkologie.de/fileadmin/user_upload/Downloads/Leitlinien/Prostatatkarzinom/Version_6/LL_Prostatakarzinom_Langversion_6.2.pdf (letzter Zugriff: 10.02.2023).
4 Mottet N, et al. EAU – EANM – ESTRO – ESUR – ISUP – SIOG Guidelines on PROSTATE CANCER – LIMITED UPDATE MARCH 2022. Online unter: https://d56bochluxqnz.cloudfront.net/documents/full-guideline/EAU-EANM-ESTRO-ESUR-ISUP_SIOG-Guidelines-on-Prostate-Cancer-2022.pdf (letzter Zugriff: 10.02.2023)
5 C.J. Gratzke et al., 630P Time course profile of adverse events of interest and serious adverse events with darolutamide in the ARAMIS trial, Annals of Oncology, Volume 32, Supplement 5, 2021, Page S664, ISSN 0923-7534, https://doi.org/10.1016/j.annonc.2021.08.1143.
6 https://www.g-ba.de/downloads/92-975-3712/2020-05-01_Nutzenbewertung-IQWiG_Darolutamid_D-543.pdf (letzter Zugriff: 10.02.2023)
Pflichtangaben NUBEQA®
Mit freundlicher Unterstützung der Bayer Vital GmbH, Leverkusen
PP-M_DAR-DE-0065-1